Reiner Kohlenstoff liegt als Kristall in zwei sehr unterschiedlichen Formen vor: Diamant ist durchsichtig, hart und elektrisch isolierend. Graphit ist metallisch glänzend, spröde und elektrisch leitfähig. Eine weitere Form reinen Kohlenstoffs entsteht, wenn man dünnste Schichten von Graphit ablöst: Graphen. Es besteht aus einer einzigen Atomlage, in der die Kohlenstoffatome in einem Wabenmuster angeordnet sind.
Graphen ist fester als Stahl und trotzdem biegsam. Zudem leitet es Strom sehr gut, bei extrem tiefen Temperaturen sogar ohne Widerstand (Supraleitung). Außerdem lassen sich die Eigenschaften anderer Stoffe, zum Beispiel Magnetismus, auf Graphen übertragen. Mögliche Anwendungen für das Multitalent sind flexible, transparente oder druckbare Elektronik, Gas- oder Biosensoren.
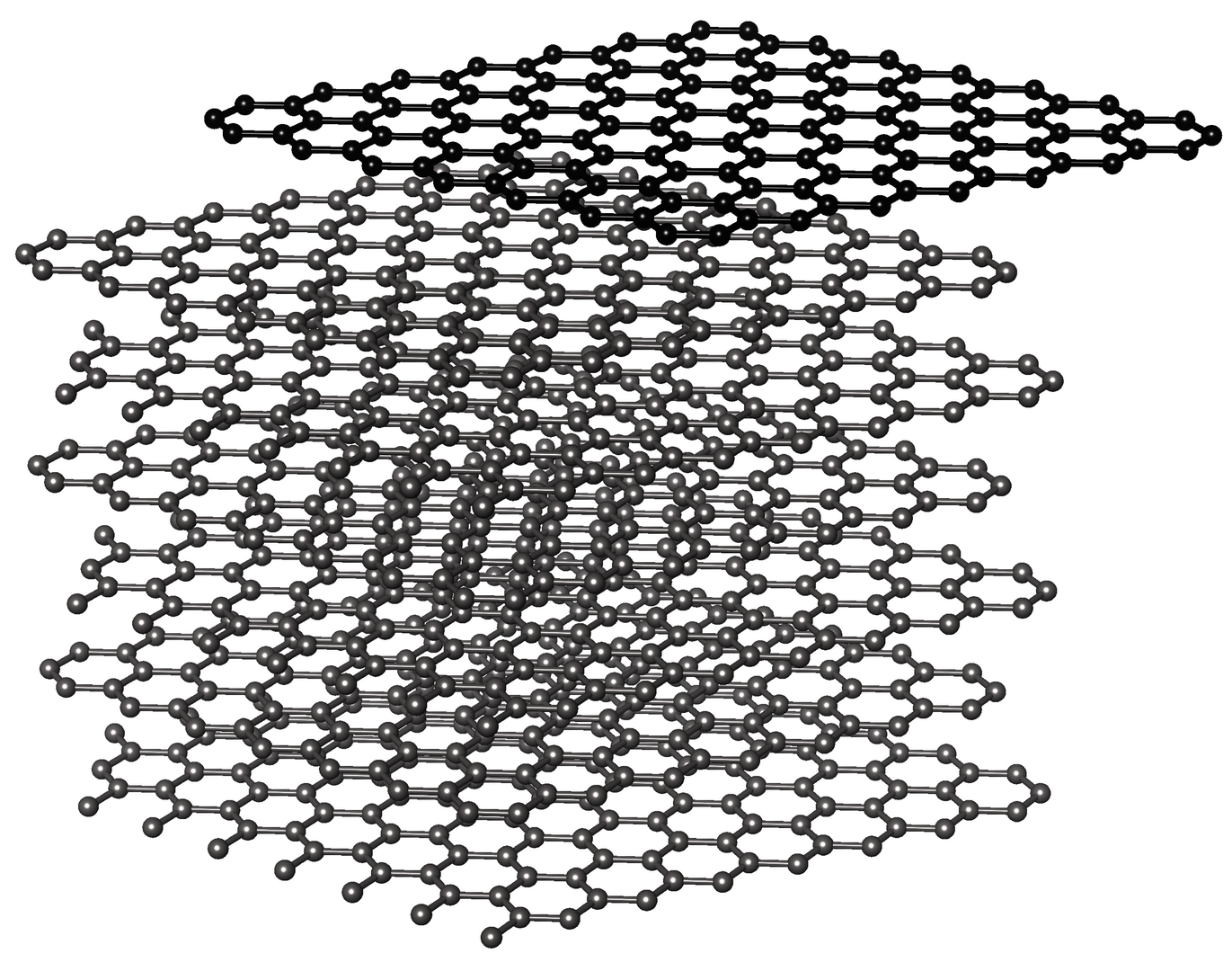
Graphit, hier hellgrau, bildet einen Schichtkristall, aus dem sich einzelne Atomlagen leicht abblättern lassen. So kann man zweidimensionale Graphenschichten isolieren. © Klaus Zollner
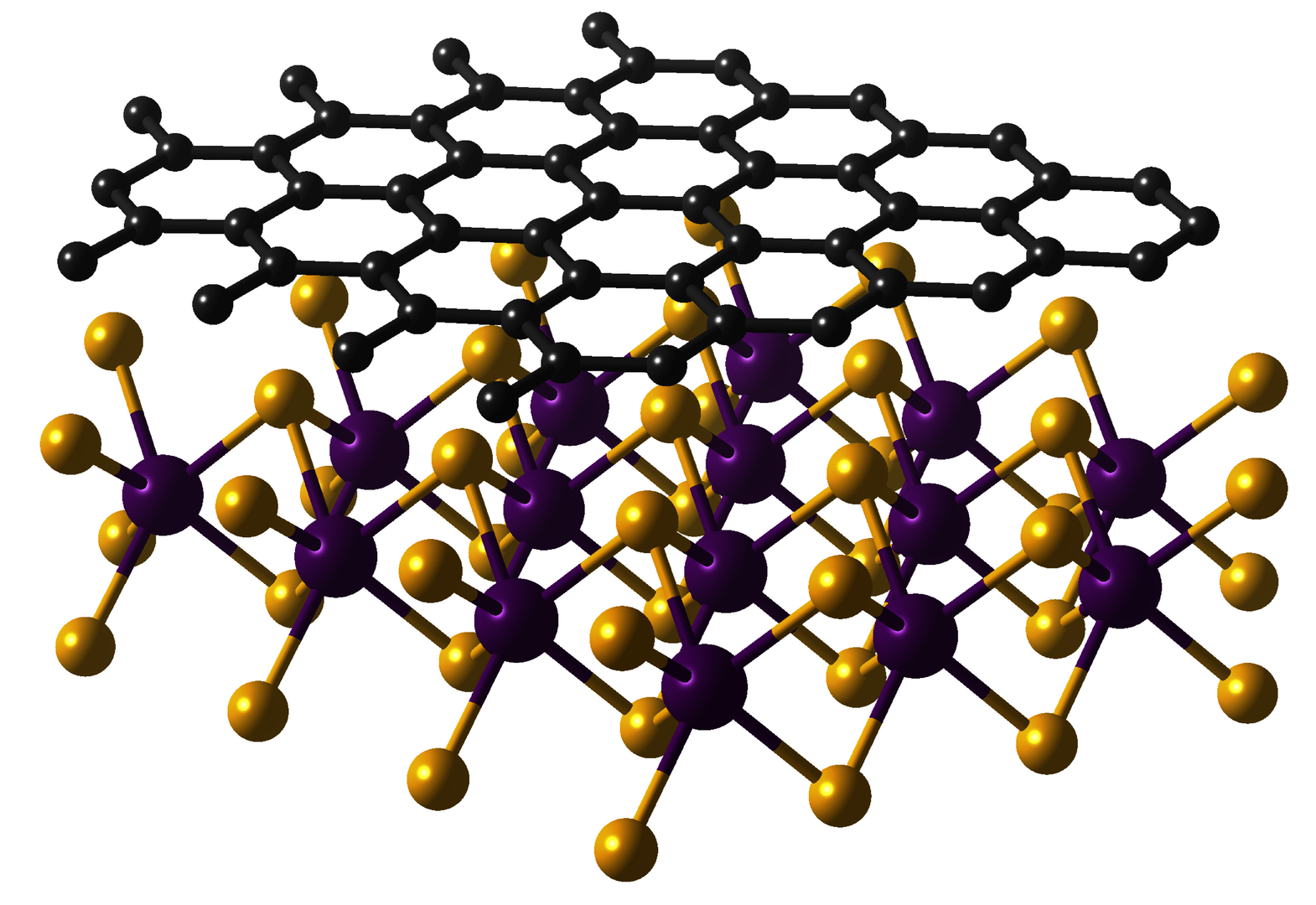
Kombiniert man verschiedene zweidimensionale Kristalle, so können die Eigenschaften des einen Materials auf das andere übertragen werden. Im Bild sieht man Graphen und Wolframdiselenid. © Klaus Zollner
Ein Graphitkristall wird auf den Klebefilm gelegt, um Graphen herzustellen. Im einfachsten Fall gelingt das sogar mit einem Bleistift und Büroklebeband! © Wolfgang Himmler